
题目列表(包括答案和解析)
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |

| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |

(1) 目前,我国火力发电厂燃料主要是煤。煤燃烧会排放出SO2和NO2,这些气体不仅污染空气,而且与空气中的物质反应后,生成的物质溶于雨水,会形成“酸雨”。请按要求回答下列问题:
①二氧化硫与空气中水份反应生成亚硫酸(H2SO3),亚硫酸易与氧气反应生成硫酸。其中亚硫酸与氧气的化学方程式是 。
②NO2是一种红棕色气体。在盛有NO2的集气瓶中放入一块活性炭,过一会儿,瓶内红棕色变淡甚至消失,活性炭具有的这种性质叫做 。
③对于SO2和NO2,小余同学归纳出了如下一些共同点,其中正确的是
A. 都是非金属氧化物 B.硫元素和氮元素化合价都为+2价
C.每个分子都由3个原子构成 D.常温常压下都是有颜色的气体
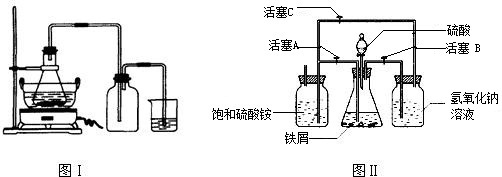
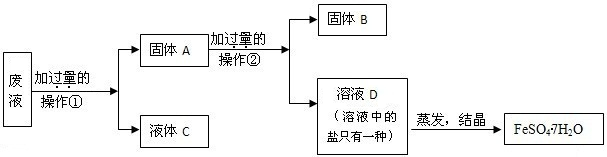
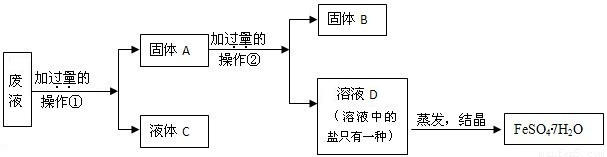
(2)五.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望。
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性。
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生;
Ⅱ. 取样品少许,加水溶解后,滴入酚酞显红色;
Ⅲ.按下图所示过程,进一步实验:

请你与小王同学一道完成下列问题的分析解答:
①氢氧化钠变质的化学反应方程式是 。
②完成步骤a、b实验,都要使用的两件玻璃仪器是 。
③步骤b中,不能用Ca(OH)2代替CaCl2的原因是——————————————————
④根据上述实验,若测定wg样品中氢氧化钠的质量分数,还须测定的数据是——
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量
现有下列实验装置,请根据要求回答:
(1)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为_____________ _ ___,
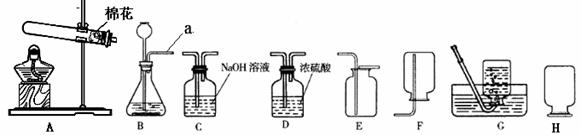 这种方法制得的氢气往往含有少量氯化氢气体,原因是_________ _____,
这种方法制得的氢气往往含有少量氯化氢气体,原因是_________ _____,
可将气体通过装置_________________除去氯化氢气体;
(2)写出使用AE 装置制取气体的化学反应方程式: 
 。
。
(3)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
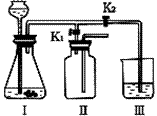 ①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
(填字母)。
a.大理石与稀盐酸反应制取收集二氧化碳
b.锌与稀硫酸反应制取收集氢气
c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质。若要证明二氧化碳能与水发生反应,应向烧杯的水中加入 。
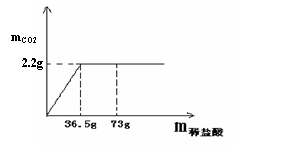
(4)现有7.5g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如下图所示。(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)该石灰石样品中碳酸钙的质量分数是多少?
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com