
题目列表(包括答案和解析)

| OH- | Cl- | CO32- | SO42- | |
| Ca2+ | 微 | 溶 | 不 | 微 |
| Mg2+ | 不 | 溶 | 不 | 溶 |
| Fe3+ | 不 | 溶 | - | 溶 |
| Cu2+ | 不 | 溶 | 不 | 溶 |

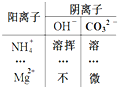 如图是“部分酸、碱和盐的溶解性表(室温)”中的一部分,据此判断下列说法正确的是( )
如图是“部分酸、碱和盐的溶解性表(室温)”中的一部分,据此判断下列说法正确的是( )| A、“溶挥”处物质的溶液具有挥发性 | B、“微”处物质的化学式为Mg2CO3 | C、氢氧化镁能溶于水 | D、“溶”处的物质属于碱 |


| 阳离子 阴离子 |
Na+ | K+ | Ba2+ |
| OH- | 溶 | 溶 | 溶 |
| SO42- | 溶 | 溶 | 不 |
| CO32- | 溶 | 溶 | 不 |
表是“部分酸、碱和盐的溶解性表(室温)”中的一部分,据此判断有关①处物质的说法不正确的是( )
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com