某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
查阅资料:
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl
2和CaCl
2)及不溶性杂质.
<资料3>部分生产流程如下图所示
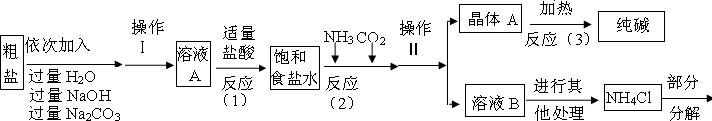
氯化铵分解的化学方程式是NH
4Cl═NH
3↑+HCl↑
<资料4>生产原理:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl,分离的晶体A,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
.
问题讨论:
(1)溶液A中的溶质为
,操作Ⅱ的名称为
.
(2)上述流程中氢氧化钠溶液的作用是
,碳酸钠溶液的作用是
(3)上述生产流程中可循环使用的是
(填序号).
A.CO
2 B.NH
3 C.HCl D.NaOH E.Na
2CO
3(4)上述反应(1)中发生了两个化学反应,写出反应的化学方程式:
,
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO
3,再滴加AgNO
3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
(写化学式).
含量测定:
同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下实验.
甲组:取12,0g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出.将反应后所得溶液
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
(必须要有写出计算过程,请在下方写出)
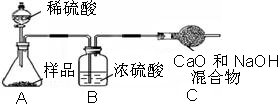
乙组:取12,0g纯碱样品,利用右图所示装置,测出反应后装置C增重了4.1g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是
.
丙组:取12.0克的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀后过滤、洗涤、烘干称量固体质量,从而计算碳酸钠的质量分数.组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是
.


 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)