
题目列表(包括答案和解析)
 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
| 16 |
| a2 |
| 16 |
| a2 |
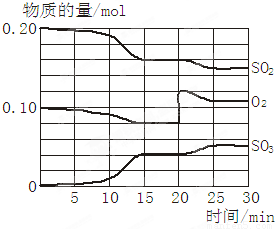
一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
(1)降低温度,SO2的转化率_______,化学反应速度____ 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是__ _______。
(3)反应进行至20 min时,曲线发生变化的原因是_____ _________________(用
文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同的条件下发生的还原反应如下:
MnO4—+ 5e + 8H+ → Mn2+ + 4H2O
MnO4— + 3e + 2H2O → MnO2 + 4OH—
MnO4— + e → MnO42—(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H+ + 2e → Mn2++2H2O
(1)MnO2 与稀盐酸不能制取氯气,其原因是 。
(2)将SO2通入KMnO4溶液中,发生还原反应的过程为______→_______
(用化学式或离子符号表示)。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是________(选填编号)。
a.氧化性:PbO2>KMnO4 b.还原性:PbO2> KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,其中K2SO4和S的物质的量之比为3:2。完成并配平该反应的化学方程式。
___KMnO4+___K2S+___ _____ → ___K2MnO4 +___K2SO4 +__S↓+___ ___
反应若生成5.44 g单质硫,反应过程中转移电子的物质的量为__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com