
题目列表(包括答案和解析)
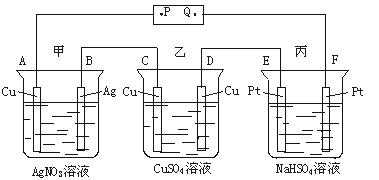
A.P是电源的正极
B.F极上发生的反应为:4OH--4e-====2H2O+O2↑
C.电解时,甲、乙、丙三池中,除了E、F两极外,其他电极均参加反应
D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变
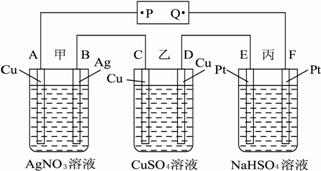
A.P是电源的正极
B.F极上发生的反应为:4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
C.通电后,甲、乙、丙三池中,除了E、F两极外,其他电极均参加了反应
D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变
 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失). ______Fe2O3+____________+____________
______Fe2O3+____________+____________
| 高温 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com