
题目列表(包括答案和解析)
合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其主要工艺流程如下:
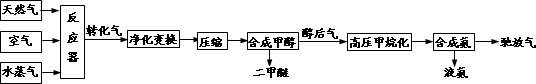
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2 ①;2CH4+O2→2CO+4H2 ②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
(1)NH3(g)→NH3(l)ΔH________0(填:“>”、“<”或“=”,下同);ΔS________0.
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
(a)减少二氧化硫排放
(b)适应低碳经济
(c)可提高氮肥产量
(d)资源综合利用率和经济效益高
(3)在催化剂、高温、高压下,CO2转化为甲烷的化学方程式为________.
(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚多少千克?________
合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其工艺流程如下:
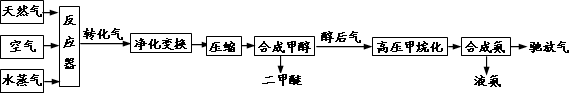
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
(1)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1323 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;及CO的燃烧热:283 kJ·mol-1.
在一定条件下,CO、H2能生成二甲醚和气态水,该热化学方程式为________.(本题涉及的条件均在同一条件下)
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
a.减少二氧化硫排放
b.适应低碳经济
c.可提高氮肥产量
d.资源综合利用率和经济效益高
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.
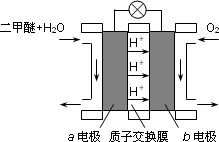
(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚________千克?
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
① 实验1条件下平衡常数K= (保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值 (填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正) v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)已知BaSO4(s) + 4C(s) =4CO(g) + BaS(s) △H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2=+226.2 kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3= kJ/mol。
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:
和
。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为
。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为:
和
。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为
。(Li的相对原子质量约为7.0)
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com