
题目列表(包括答案和解析)
在一容积为2L的密闭容器中,充入4mol氮气和12mol氢气,使其在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为 ;
(2)H2在2min末的体积分数为 (保留两位有效数字);
(3)2min末N2的转化率为 ;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H—H键要消耗436kJ的能量,而形成1mol N—H键会放出391kJ的能量。试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会 (填“放出”或“吸收”) 热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是 。
在一容积为2L的密闭容器中,充入4mol氮气和12mol氢气,使其在一定条件下发生反应:N2(g)+3H2(g)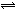 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为 ;
(2)H2在2min末的体积分数为 (保留两位有效数字);
(3)2min末N2的转化率为 ;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H—H键要消耗436kJ的能量,而形成1mol N—H键会放出391kJ的能量。试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会 (填“放出”或“吸收”) 热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是 。
 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:工业上通常在恒容密闭容器中采用CO(g)和H2 (g)反应催化合成甲醇CH3OH(g):
(1)已知:① 2CO(g) + O2 (g) = 2CO2 (g) ΔH =" -566.0" kJ·mol-1
② 2H2(g) + O2 (g) ="2" H2O (g) ΔH =" -398.0" kJ·mol-1
③2CH3OH(g) +3O2 (g) =2CO2 (g) +4 H2O(g) ΔH =" -1104.0" kJ·mol-1
则CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_______________。
(2)据研究,反应过程中起催化作用的为CuO,反应体系中含少量CO2有利于维持催化剂CuO的量不变,原因是:_______________________________ (用化学方程式表示)。
(3)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 混合气体的密度不变
B. 混合气体的平均相对分子质量不变
C. CH3OH(g)、CO(g)、H2(g)的浓度都不再发生变化
D.生成CH3OH(g)的速率与消耗CO(g)的速率相等
(4)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.250 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | CH3OH的浓度(mol/L) | c 1 | c 2 | c 3 |
| 反应的能量变化的绝对值(kJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
工业上通常在恒容密闭容器中采用CO(g)和H2 (g)反应催化合成甲醇CH3OH(g):
(1)已知:① 2CO(g) + O2 (g) = 2CO2 (g) ΔH =" -566.0" kJ·mol-1
② 2H2(g) + O2 (g) ="2" H2O (g) ΔH =" -398.0" kJ·mol-1
③2CH3OH(g) +3O2 (g) =2CO2 (g) +4 H2O(g) ΔH =" -1104.0" kJ·mol-1
则CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_______________。
(2)据研究,反应过程中起催化作用的为CuO,反应体系中含少量CO2有利于维持催化剂CuO的量不变,原因是:_______________________________ (用化学方程式表示)。
(3)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 混合气体的密度不变
B. 混合气体的平均相对分子质量不变
C. CH3OH(g)、CO(g)、H2(g)的浓度都不再发生变化
D.生成CH3OH(g)的速率与消耗CO(g)的速率相等
(4)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.250 |
0.012 |
某温度下,将2molCO(g)和6mol H2(g)充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol/L,则CO(g)的转化率为________,此时的温度为__________。
(5)要提高CO(g)的转化率,可以采取的措施是__________。
A. 升高温度 B. 加入催化剂 C. 增加CO(g)的浓度
D. 加入H2(g)加压 E. 分离出甲醇 F.加入惰性气体加压
(6)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO 2molH2 |
1molCH3OH |
2molCH3OH |
|
|
平衡数据 |
CH3OH的浓度(mol/L) |
c 1 |
c 2 |
c 3 |
|
反应的能量变化的绝对值(kJ) |
a |
b |
c |
|
|
体系压强(Pa) |
P1 |
P2 |
P3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是__________。
A. 2c1>c3 B. a+b=129 C. 2p2<p3 D. α1+α3<1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com