
题目列表(包括答案和解析)
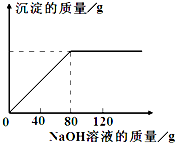 从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:
从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:
从海水中可以提取镁,其中的一个步骤是将卤水(含Mgcl2、NaCl、KCl的混合液)转化为氯化镁晶体.实验室中模拟该转化的过程如下,回答有关问题a
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤.
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)________
②过滤操作需用到的玻璃仪器除烧杯外,还有________.
(2)制各氯化镁溶液:用盐酸溶解Mg(OH)2.为了便于后续操作.盐酸不宜过量
①反应的化学方程式是________.
②通过计算,可准确知道所需盐酸的量.理论上溶解5.8 gMg(OH)2需要36.5%HCl溶液
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到到控制盐酸用量的目的.操作是:将Mg(OH)2加入烧杯中,________直到Mg(OH)2完全溶解为止.
(3)制各氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com