
题目列表(包括答案和解析)
在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜(CuSO4),拟选择两个方案。
| 方案 | 方案① | 方案② |
| 原理 | CuS是在硫杆菌(催化剂)的作用下与空气中的氧气发生化合反应生成硫酸铜。 | 2CuS+3O2 CuO+H2SO4==CuSO4+H2O |
(1)请写出方案①反应的化学方程式___ 。
(2)在两个方案中①更合理。理由是方案①具有以下优点:优点一:__________,优点二:__________。
在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜,拟选择两个方案。
| 方案 | 方案① | 方案② |
| 原理 | CuS是在硫杆菌(催化剂)的作用下与空气中的氧气发生化合反应生成硫酸铜。 | 2CuS+3O2 CuO+H2SO4==CuSO4+H2O |
(1)请写出方案①反应的化学方程式______________________________________________。
(2)在两个方案中①更合理。理由是方案①具有以下优点:
优点一:__________________________________
优点二:__________________________________
在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜,拟选择两个方案。
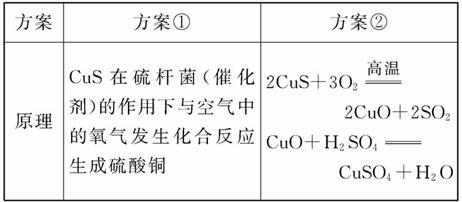
(1)请写出方案①反应的化学方程式__________。
(2)从环境保护的角度考虑,两个方案中选_______(填“方案①”或“方案②”)更合理,理由是______________________________________ _______________。
_______________。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 有 ① 生成,说明有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 | 试管中有 ②生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
| 步骤4:取适量滤液于试管中, ④ 。 | 试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 有 ① 生成,说明有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 | 试管中有 ②生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
| 步骤4:取适量滤液于试管中, ④ 。 | 试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com