
题目列表(包括答案和解析)

| 实验步骤 | 实验现象 | 实验结论 |
| 取小烧杯中的物质进行 过滤 过滤 (填操作名称),得到固体和液体. |
猜想三正确 | |
| 向滤液中加入适量 石蕊 石蕊 溶液; |
溶液变蓝 | |
| 向固体中加入适量稀盐酸. | 有气泡产生 有气泡产生 |
| 加入盐酸溶液的质量/g | 0 | 2 | 3.65 | 6 |
| 样品的pH | 12 | 9 | 7 | 4 |
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |

某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。

【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
|
物质性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
|
颜色 |
黑色 |
黑色 |
红色 |
黑色 |
|
能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。

A.收集CO B.吸收CO2 C.检验CO2
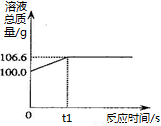
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
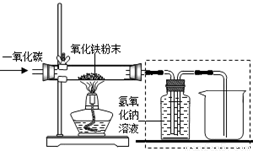
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
|
物质性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
|
颜色 |
黑色 |
黑色 |
红色 |
黑色 |
|
能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com