
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 | 结论 | |
| 方案1 | 取少量氢氧化钠溶液放入试管中,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 假设一成立 |
| 方案2 | 取少量氢氧化钠溶液放入试管中,滴入过理BaCl2溶液,再滴入无色酚酞试液 | 有白色沉淀产生,酚酞变红 | 假设 |
| 有白色沉淀产生,酚酞不变红 | 假设 |
| 实验步骤 | 实验现象 | 结论 | |
| 方案1 | 取少量氢氧化钠溶液放入试管中,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 假设一成立 |
| 方案2 | 取少量氢氧化钠溶液放入试管中,滴入过理BaCl2溶液,再滴入无色酚酞试液 | 有白色沉淀产生,酚酞变红 | 假设______成立 |
| 有白色沉淀产生,酚酞不变红 | 假设______成立 |

某校学生在配制氢氧化钠溶液后忘记塞瓶塞。对于该溶液是否变质,他们提出了如下假设:
假设一:该溶液没有变质
假设二:该溶液部分变质
假设三:该溶液全部变质
他们提出氢氧化钠溶液变质的理由是________________________________________________。
Ⅰ.定性研究
为了验证以上假设,甲组同学设计了如下两个实验方案:(提示:氯化钡溶液显中性)
| 实验步骤 | 实验现象 | 结论 | |
| 方案1 | 取少量氢氧化钠溶液放入试管中,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 假设一成立 |
| 方案2 | 取少量氢氧化钠溶液放入试管中,滴入过理BaCl2溶液,再滴入无色酚酞试液 | 有白色沉淀产生,酚酞变红 | 假设_____成立 |
| 有白色沉淀产生,酚酞不变红 | 假设_____成立 |
【交流讨论】
乙组同学认为他们的实验方案不严密,方案一不能证实溶液没有变质。后经研究,方案一改进如下:取少量该溶液于试管中,加入足量的____________,若无气泡产生,则假设一成立。
最后经过同学们共同努力,得出结论:假设二成立。于是他们继续研究下去。
Ⅱ.定量探究
【提出问题】该瓶溶液中碳酸钠的质量是多少呢?
【设计实验】同学们讨论后认为只要收集上述实验中的相关数据,通过计算就可以得出样品中碳酸钠的质量。你认为该相关数据是_____________。
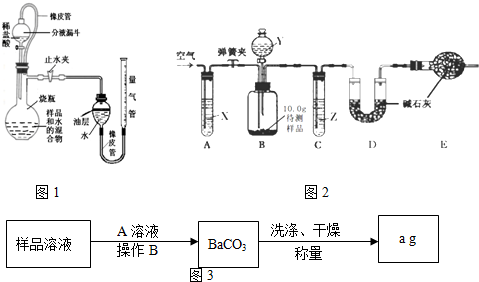
(1)测定二氧化碳的体积,甲组同学设计了下图所示的实验装置(铁架台等固定装置已略去),取待测样品,进行实验。
 【实验步骤】
【实验步骤】
①如图所示,连接好装置,检查装置气 密性良好;
密性良好;
②称一定量的样品置于烧杯中,加入适量水混合,完全溶解后全部倒入右图的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO2的密度,计算样品中碳酸钠的质量分数。
【问题讨论】
图中油层的作用为 ,油层上方留有空气,会使测量结果 (填“偏大”、“偏小”或“不受影响”)。中和反应明显放出热量,滴加稀盐酸后,发生装置里发生的中和反应的化学方程式为 ,这个反应的发生可能使测定结果 (填“偏大”、“偏小”或“不受影响”)。
(2)测定二氧化碳的质量。乙组同学提出了可以用如下装置测定二氧化碳的质量(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物)。
取10.0g待测样品,进行实验.实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
 f.再次称量装置D的质量为84.5g。
f.再次称量装置D的质量为84.5g。
【交流讨论】
①试剂X、Y、Z依次最适宜选用___________(选填字母)
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是______________________________________。
③若没有装置C,则会导致测定结果________(选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果_________。
【交流讨论】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数。
(3)丙组同学提出还可以用如下方案测定碳酸钠的质量

①该实验要求加入的A溶液必须过量,检查A溶液已过量的方法是________________________
②操作B的名称是____________________,该操作用到的玻璃仪器有______________________。

| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | / | |
| 2 | 2.0 | CuO0.5 | |
| 3 | 2.0 | MnO20.5 |
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com