
题目列表(包括答案和解析)
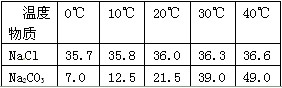
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |

| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
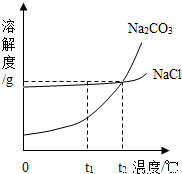
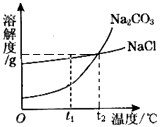
 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com