(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na
2CO
3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na
2CO
3。
则NaOH变质反应的化学方程式为
。
【查阅资料】
①碱性的Na
2CO
3溶液可以与中性的CaCl
2溶液发生复分解反应;
②CO
2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作
| 实验现象
| 实验结论
|
(1)取少量样品溶于水,加入 ;
| 白色沉淀产生
| 该反应的化学方程式: ;
|
(2)将上述反应后的混合物过滤,取滤液加入 。
| 。
| 证明猜想Ⅱ正确
|
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
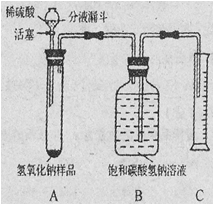
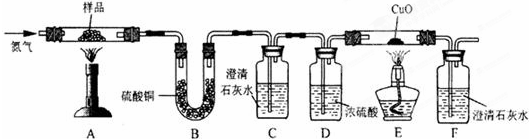
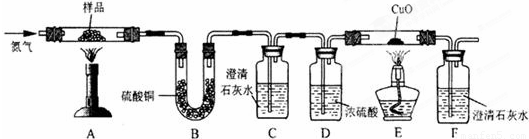
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是
;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是
;
(3)试管中原有的空气对实验结果是否有明显影响?
(填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为
。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
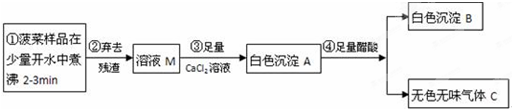
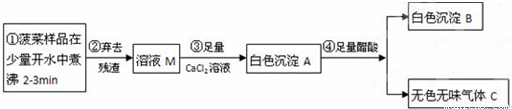
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
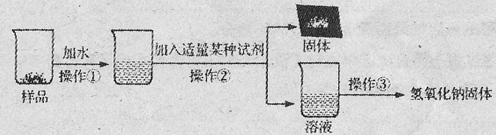
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。

请回答下列问题:
(1)操作①、②、③的名称分别为
,为了使样品充分溶解,操作①中还要用到的玻璃仪器是
;
(2)该实验中发生反应的化学方程式为
;
(3)最终所得氢氧化钠固体质量
变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有
(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是
。