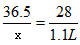小马同学对蛋壳(蛋壳的主要成分是碳酸钙)开展了有关探究。过程如下:将7.5克的蛋壳放入容器中,往其中加入足量的稀盐酸,充分反应,收集到CO
2气体体积1.1L(CO
2的密度为2g/L)。【假设二氧化碳全部是由蛋壳中的碳酸钙与盐酸反应产生,蛋壳的其它物质不与稀盐酸反应。】以下是小马同学的部分实验报告:计算参加反应的盐酸质量为多少克?计算过程如下:
解:设参加反应的盐酸质量为x。
CaCO
3+ HCl===CaCl
2+H
2O+CO
2↑
36.5 28
x 1.1L
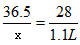
x=3g
答:参加反应的盐酸质量为3g。
(1)小马的计算过程中出现多处错误,请你列出其中的两处错误:
Ⅰ:
;Ⅱ:
。
(2)请你根据小马的实验数据计算这些蛋壳中碳酸钙的质量分数。(写出计算过程)