
题目列表(包括答案和解析)
| A、根据分子是由原子构成的进行分析判断. B、含有碳元素的化合物叫有机化合物,简称有机物. C、由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质. D、相对分子质量(式量)单位是“1”,不是“克”,常常省略不写. | |
| 解答: | 解:A、分子是由原子构成的,1个N4分子由4个氮原子构成的,故选项说法错误. B、N4是由一种元素组成的纯净物,是一种新型的单质,不属于有机物,故选项说法错误. C、N4和N2都是由氮元素形成的不同物质,都是单质,互为同素异形体,故选项说法正确. D、相对分子质量(式量)单位是“1”,不是“克”,常常省略不写,故选项说法错误. 故选C. |
| A、根据甲、乙、丙三种物质的微观构成,分析构成物质的微粒; B、根据甲、丙两种物质的微观构成,分析物质的类别; C、根据化学反应的微观示意图中微粒的变化,分析分子、原子的变化; D、根据甲、乙、丙三种物质的微观构成,分析物质的类别. | |
| 解答: | 解:A、由甲、乙、丙三种物质的微观构成可知,甲、丙是由分子构成的、乙是由原子直接构成的.故A错误; B、由甲、丙两种物质的微观构成可知,甲是由汞、氧两种元素组成,属于氧化物,丙是由同种氧元素组成,属于单质.故B错误; C、由化学反应的微观示意图中微粒的变化可知,化学反应前后每种原子的种类及个数没有改变.故C正确; D、由甲、乙、丙三种物质的微观构成可知,甲属于化合物,乙、丙物质都属于单质.故D错误. 故选C. |


| ||
| ||
| 84(m1-m2) |
| 31(m1-a) |
| 84(m1-m2) |
| 31(m1-a) |


A~I都是初中化学中的常见物质,且有如图所示转化关系(部分反应物、生成物及反应条件均已略去)。已知A为金属单质,其它均为化合物。F为大理石的主要成分,E为一种常见的不挥发性酸。
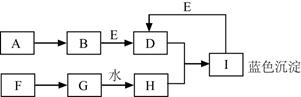
回答下列问题:
(1)写出下列物质的化学式:A 、G 。
(2)写出反应的化学方程式:
①D溶液+H溶液: ;②I+E溶液: 。
【解析】根据题干提供的信息,找准解题的突破口,直接得出物质的化学式,F为大理石的主要成分,则F是碳酸钙,F生成的G能与水反应生成H,H能与D反应生成蓝色沉淀I,蓝色沉淀是氢氧化铜,则H是氢氧化钙,G是氧化钙,,E为一种常见的不挥发性酸,则E是稀硫酸,能与氢氧化铜反应生成D硫酸铜,故B中含有铜元素,A为金属单质,则A为铜,B为氧化铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com