某些镁的合金,密度不足钢铁的
,却有刚铁的强度,是制造汽车、飞机、火箭的重要材料;镁在制取高强度的轻合金中也有重要的地位.目前世界上60%的镁是从海水中提取的.
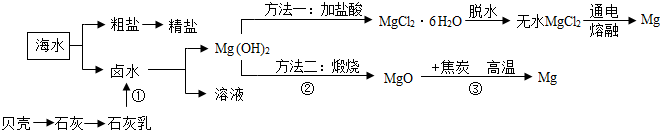
【相关资料】
①海水中镁离子(Mg
2+)的浓度为1.28g/L;
②海水晒盐后得到的母液(又称为卤水)中含有MgCl
2、KCl等物质;
③Mg(OH)
2受热会分解为MgO和H
2O;
④MgCl
2的熔点为714℃,熔融的氯化镁通入直流电后,会分解产生镁.
【问题讨论】
(1)海水中已有氯化镁,为什么人们要通过以上流程获得氯化镁?
.
(2)反应①中得到Mg(OH)
2的化学方程式为
.
(3)为了使海水中的Mg
2+全部转化为沉淀,加入的石灰乳应该过量,则判断加入的石灰乳过量的方法是
(写出操作、现象和结论).
(4)“方法一”由MgCl
2制Mg所发生的能量转化为:
能转化为
能;此反应需要在特殊的真空环境下进行,这样做的目的是
.
(5)反应③中得到Mg的化学方程式为
.
(6)从海水中获得的粗盐中含有的SO
42-、Ca
2+、Mg
2+等杂质,为获得精盐,设计了如下操作:
①溶解;②加过量的Na
2CO
3溶液; ③加过量的BaCl
2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是
(用序号填一种合理组合).
【组成确定】
(1)取一定质量的“方法一”制得的镁样品,用蒸馏水浸泡片刻,取上层清液,加入
溶液,若无沉淀产生,则样品中不含MgCl
2;
(2)另取一定质量的“方法二”制得的镁样品,加入足量稀盐酸,充分搅拌、过滤,得少量的黑色残渣.将该黑色残渣在氧气中充分灼烧,将产生的气体通入澄清石灰水中,石灰水浑浊.由上述实验可确定该镁样品含有杂质
(写化学式).
【含量测试】
为了测定“方法二”制得的镁样品中镁的含量,利用该样品与硫酸溶液反应,进行了三次实验,所得相关的实验数据记录如下(样品中的杂质不反应):
|
第一次 |
第二次 |
第三次 |
| 所取样品的质量/g |
9 |
9 |
18 |
| 所用硫酸溶液质量/g |
60 |
80 |
50 |
| 生成氢气的质量/g |
0.6 |
0.6 |
0.6 |
试利用表中的有关实验数据,计算该镁的样品中镁的质量分数(写出计算过程).

