
题目列表(包括答案和解析)
右图是某工业盐产品质量指标。为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀。(反应为:BaCl2+Na2CO3=BaCO3↓+2NaCl)。
⑴100g该工业盐中含氯化钡的质量。
⑵通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标?
右图是某工业盐产品质量指标。为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
①用碳酸钠来测定杂质氯化钙的质量分数,得到1g沉淀。
②测得水的质量分数为3.3%:
求:(1)100g该工业盐中含氯化钙的质量分数。
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标?
| (工业盐) 氯化钠(%)≥95.5 水分(%)≤3.4 氯化钙(%)≤1.1 |
某盐场生产的工业盐产品质量指标如右图:为了测定该工业用盐中氯化钠的质量分数是否符合产品质量指标,进行如下实验:
①取100g该工业盐加热烘干,测得水的质量为3.36g,
②另取100g该工业盐溶于水中加入足量碳酸钠溶液得到碳酸钡沉淀1.97g, 
(反应方程式为![]() :BaCl2+Na2CO3===BaCO3↓+2NaCl)
:BaCl2+Na2CO3===BaCO3↓+2NaCl)
求:(![]() 1)100g该工业盐中含氯化钡的质量。
1)100g该工业盐中含氯化钡的质量。
(2)通过计算,判断该工业盐中氯化钠的质量分数是否符合产品质量指标。
2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(1)很多品牌牙膏都标有“含氟”字样,其中的“氟”是指
A.氟单质 B.氟元素 C.氟原子
(2)牙膏去污主要是利用了摩擦作用。某品牌牙膏中的摩擦剂是碳酸钙,为了检验并测定牙膏中碳酸钙的质量分数,同学们取了10g牙膏,加入足量稀盐酸并搅拌。实验过程中记录并处理数据形成右图曲线:
该品牌牙膏中碳酸钙的质量分数为多少。

|
|
|
 |
①“煅烧炉”中发生反应的化学方程式是: ,在“反应池”中主要发生反应的化学方程式是: 。
②“沉淀池”中生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆,熟石灰浆为
(选填“悬浊液”或“溶液”或“乳浊液”)。
③有人建议在上述流程中用CO2替代“碳酸钠溶液”。这样做的优点是 。
小王查阅资料后得知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+ H2O + CO2=Ca(HCO3)2;
|
Ca(HCO3)2===== CaCO3↓+H2O+ CO2↑;
为了防止利用该法制得的轻质碳酸钙中混有Ca(HCO3)2,操作2中必需要进行的一步操作是 。
创新利用CO2,倡导低碳生活,发展低碳经济已成为一种环保时尚。
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 ▲ 的程度。
(2)2014年青奥会即将在南京举行,为了控制汽车尾气给空气造成的污染,南京市在燃料的使用和管理等方面采取了一些有效措施。右图中公交车使用的燃料主要成分是天然气,其完全燃烧的化学方程式为 ▲ 。
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”C O2,过程如下图所示(部分条件及物质未标出)。
O2,过程如下图所示(部分条件及物质未标出)。

①捕捉室中发生反应的化学方程式为 ▲ 。
②把CaO放入反应 分离室中与H2O反应,该反应的化学方程式为 ▲ ;
分离室中与H2O反应,该反应的化学方程式为 ▲ ;
利用此反应,氧化钙可用作食品 ▲ 剂。
③“反应 分离”中,得到固体物质的基本操作是 ▲ ,该固体是碳酸钙。
分离”中,得到固体物质的基本操作是 ▲ ,该固体是碳酸钙。
 ④整个过程中,可以循环利用的物质有 ▲ 。
④整个过程中,可以循环利用的物质有 ▲ 。
(4)称取某纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2% | 98.8% | 98.0% |
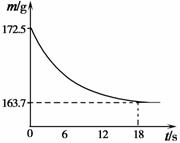
请通过计算并结合图表回答:
①反应生成CO2的质量为 ▲ g。
②判断此纯碱样品的等级。
计算过程:
▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com