
题目列表(包括答案和解析)

| ||
| ||
金属钛(Ti)的合金具有耐高温、耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应的化学方程式为:2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
2TiCl4+2X+6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
请根据以上信息回答下列问题:
(1)FeTiO3中钛元素的化合价为________.
(2)在制备TiCl4的反应中,X的化学式为________.
(3)镁与TiCl4反应的化学方程式为________.
| ||
| A、FeTiO3中Ti的化合价为+3 |
| B、X是Ti |
| C、FeTiO3中Ti的化合价为+4,X是Mg |
| D、X是FeCl3 |
金属钛(Ti)的合金具有耐高温,耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应化学方程式为:2FeTiO3+6C+7Cl2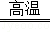 2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
(1)FeTiO3中钛元素的化合价为 价.
(2)在制备TiCl4的反应中,X的化学式为 .
(3)镁与TiCl4反应的化学方程式为: .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com