
题目列表(包括答案和解析)
取含有80 g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况下CO2的密度为1.977 g/L)
取含有80 g碳酸钙的石灰石,与足量的稀盐酸反应,可得到二氧化碳多少克?标准状况下二氧化碳的体积是多少升?(已知:标准状况下CO2的密度是1.997 g/L)
我市某地盛产石灰石,其中含有不溶于盐酸的杂质.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0 g石灰石样品,经粉碎后全部放入烧杯中,并加入足量的稀盐酸,烧杯及所盛物质的总质量为80.0 g.反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
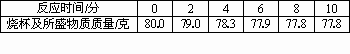
试计算:
(1)反应结束后,共放出多少克的二氧化碳?
(2)该石灰石样品中碳酸钙的质量分数是多少?
化学中质量守恒定律是一个非常重要的定量定律.
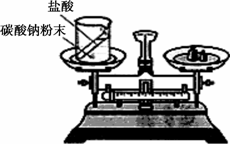
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1________m2,其原因为________.
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如下所示.

①1个B分子中含有________个原子.
②四种物质中属于化合物的是________(填图中字母).
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是10 g.有关实验数据见下表:
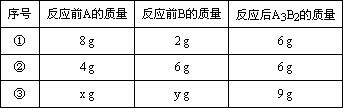
X∶Y的比值可能为________或________.
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案](1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
[进行实验]甲组同学:称取24.00 g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00 g.
乙组同学:称取24.00 g样品,加入足量的稀盐酸直到反应停止,共收集到8.80 g二氧化碳.
[解决问题]请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1%)
________.
| 56 |
| x |
| 44 |
| 4.4g |
| 56 |
| x |
| 44 |
| 4.4g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com