
题目列表(包括答案和解析)
| A、化学反应发生时不一定能观察到明显的现象 | B、从元素周期表中可以查出元素的相对原子质量 | C、配平化学方程式的依据是质量守恒定律 | D、一定温度下,向溶液中加入溶质都会使其浓度增大 |
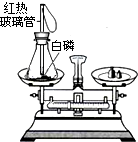 化学反应都遵守质量守恒定律,请根据质量守恒定律的相关知识完成下列问题:
化学反应都遵守质量守恒定律,请根据质量守恒定律的相关知识完成下列问题:
| ||
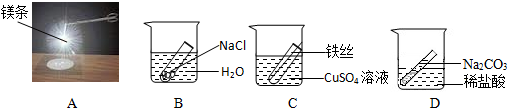
| 点燃 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com