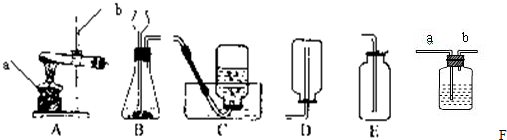
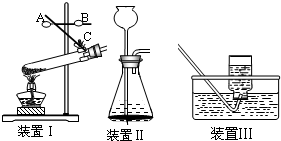
某班级的几个兴趣小组用如下图中学化学实验常见的实验装置探究氧气的实验室制法
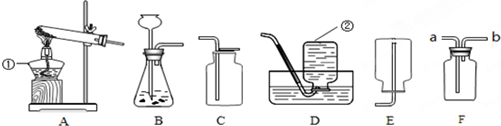
(1)请写出有标号仪器的名称:①
酒精灯
酒精灯
;②
集气瓶
集气瓶
.
(2)甲小组用过氧化氢溶液和二氧化锰反应制取较纯净的氧气,发生装置和收集装置是
BD
BD
,其化学方程式是
.收集氧气也可用F装置,气体应从
a
a
(填“a”或“b”)端管口通入.
(3)乙小组用氯酸钾和二氧化锰混合物制取氧气,反应的化学方程式是
,二氧化锰在其中起
催化
催化
作用,化学反应前后,二氧化锰的
质量
质量
和
化学性质
化学性质
不变.为了测定一定质量的氯酸钾产生氧气的量,乙小组还进行了如下实验研究:
【实验过程】:称取-定质量的氯酸钾和二氧化锰混合物16.0g,放入大试管中加热至质量不再变化为止,称得固体质量为11.2g.
【数据处理】:①根据质量守恒定律,计算得到氧气的质量为
4.8
4.8
g.②列式计算混合物中氯酸钾的质量.
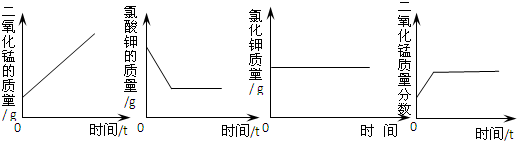
【反思应用】:下列图象能正确表示上述实验过程的是
D
D
.
(4)丙小组用高锰酸钾制取氧气,他们称取一定质量的高锰酸钾固体放入A装置中,指出A装置的不足之处是
试管口没有棉花团
试管口没有棉花团
,将装置改进后,将温度控制在250℃加热制取O
2.实验结束时,乙同学发现用排水法收集到的O
2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】
猜想Ⅰ:反应生成的MnO
2分解放出O
2;
猜想Ⅱ:反应生成的K
2MnO
4分解放出O
2;
猜想Ⅲ:反应生成的K
2MnO
4和MnO
2分解放出O
2.
【实验验证】:同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO
2,在250℃条件下加热一段时间,冷却后测得MnO
2的质量不变,则猜想
Ⅰ
Ⅰ
错误;
第二组同学取K
2MnO
4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是
用带火星的木条放入在试管中,木条复燃
用带火星的木条放入在试管中,木条复燃
.
【拓展延伸】:实验发现,用氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾的分解速率大大加快,请说明高锰酸钾在氯酸钾的分解反应中是否作催化剂,为什么?
高锰酸钾不是催化剂;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,其中使氯酸钾的分解速率大大加快的是分解出的二氧化锰,而不是高锰酸钾
高锰酸钾不是催化剂;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,其中使氯酸钾的分解速率大大加快的是分解出的二氧化锰,而不是高锰酸钾
.