
题目列表(包括答案和解析)
(11分)煤、石油和天然气等化石燃料是目前人类使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有 两种元素(填写元素符号);天然气的主要成分是 (填写化学式)。
(2)化石燃料属于 (选填“可再生”或“不可再生”)能源,其燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式: KAlSi3O8+CO2+2H2O==KHCO3+X+3SiO2↓,则X的化学式为 。
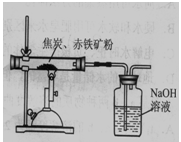
(3)工业上,煤炭燃烧前进行粉碎的目的是 。煤隔绝空气加强热得到的焦炭,是冶铁的重要原料。为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应)。
方案I 取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣。则赤铁矿粉中氧化铁的质量分数为 。
方案Ⅱ 如图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32g。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3△4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数为 。
[实验反思]方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,这会导致测出的氧化铁的质量分数 (选填“偏大”、“偏小”或“不变”)。
[实验分析]方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是 (写出一种即可)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com