
题目列表(包括答案和解析)


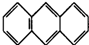 ,平面结构)属于
,平面结构)属于| T/℃t/min pH | 3.0 | 4.0 | 5.0 | 6.0 | 20 | 301 | 231 | 169 | 58 | 30 | 158 | 108 | 48 | 15 | 50 | 31 | 26 | 15 | 7 |
阅读资料,获取信息,回答问题。
(A) A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C的原子序数为24;D2+的电子排布式和Ar相同。
(B)两元素电负性差值大于1. 7,原子间一般形成离子键;小于1. 7,原子间一般形成共价键。
(C)下列是周期表中部分元素的电负性x和第一电离能I1 (KJ·mol-1):
(1).A原子的轨道表示式为 ,B原子的价电子排布式为 ,C原子的电
子排布式为 ,D在周期表中的位置为________周期________族。
(2).电负性最小的元素位于 族,第一电离能最大的元素是(填元素符号) ;
锂元素的电负性取值范围为 <x(Li)< ;A12S3属 化合物
(3)标出化合物OF2、 LiAlH4中各元素的化合价(写在元素符号上)。
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2
+[O]-Q 平衡常数为K1 ;
O2
+[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
|
pH t / min T / ℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com