
题目列表(包括答案和解析)
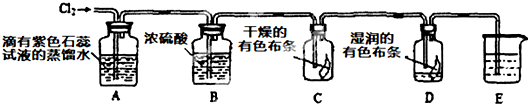
| ||
| ||
(12分)根据要求填写:
(1)金属钠在空气中燃烧,火焰呈 色,化学方程式: ;
(2)将过氧化钠固体放入试管中加入少量水,再加入几滴酚酞试液,溶液变红色但很快褪色,原因是: ,过氧化钠固体与水反应的化学方程式:  ;
;
(3)苏打和小苏打分别和同浓度的盐酸反应,反应较快且剧烈的是 (填化学式),小苏打与盐酸反应的离子方程式为:  ;
;
(4)金属钠和金属钾分别和水反应试验中,其中反应较剧烈的反应的化学方程式: ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com