(2011?福建模拟)电镀废水、废渣的处理和综合利用体现了绿色化学的思想.
Ⅰ.含铬电镀废水的处理可采用以下方法:
(1)电解法.往废水中加入适量氯化钠,以铁为电极进行电解,电解过程中,阳极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
.
(2)沉淀法.含铬废水中存在平衡:Cr
2O
72-+H
2O?2CrO
42-+2H
+.往废水中加入BaCl
2,铬元素转化为铬酸钡(BaCrO
4)沉淀,此过程中,还应加入NaOH,理由是
使平衡Cr2O72-+H2O?2CrO42-+2H+右移,有利于除铬
使平衡Cr2O72-+H2O?2CrO42-+2H+右移,有利于除铬
.
Ⅱ.某工厂利用富含镍(Ni)的电镀废渣(含有Cu、Zn、Fe、Cr等杂质)制备NiSO
4?6H
2O.其生产流程如图所示:
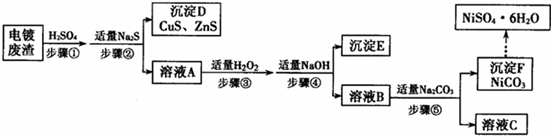
(3)步骤①中加入H
2SO
4后,需充分搅拌的目的是
提高废渣的溶解速率和溶解程度
提高废渣的溶解速率和溶解程度
.
(4)步骤③中,在酸性条件下,H
2O
2使Fe
2+转化为Fe
3+的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.
(5)已知:ⅰ.Ksp[Fe(OH)
3]=2.5×10
-39、Ksp[Cr(OH)
3]=6.3×10
-31;ⅱ.溶液中离子浓度小于10
-5 mol?L
-1时,可视为沉淀完全.25℃时,若沉淀E为Fe(OH)
3和Cr(OH)
3,步骤④中,应控制溶液的pH不小于
5.6
5.6
.(提示:lg2.5×10
-39=-38.6,lg6.5×10
-31=-30.2)
(6)溶液C中溶质的主要成分是
Na2SO4
Na2SO4
.

