
题目列表(包括答案和解析)



| ||
| ||
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下: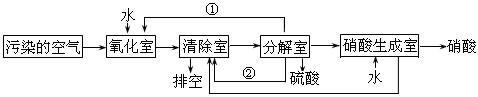
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
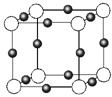
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。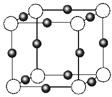
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下: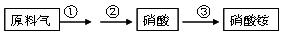
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:
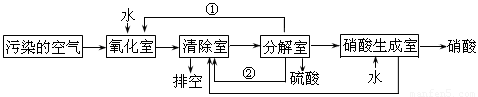
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:
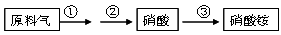
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)

 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com