
题目列表(包括答案和解析)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol
,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol
,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________ (填字母)。[来源:学*科*网Z*X*X*K]
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) ![]() 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) ![]() 。
。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________ (填字母)。[来源:学*科*网Z*X*X*K]
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4。
请回答:
(1)X的电子式 ;若实验室用如图所示装置制取X,则制取X的化学反应方程式为 。
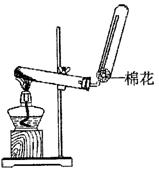
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,
进行如下实验,请补全实验操作、现象和结论:
取上述白色沉淀少量置于试管中,
。
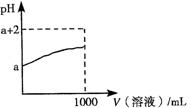
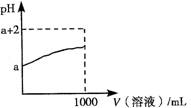
(3)常温下,取10 mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为 ,下列叙述正确的是 (选填字母)。
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化:
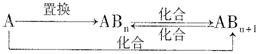
当n=1时,请写出A—ABn的化学方程式 (写出一个即可)。
X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4。
请回答:
(1)X的电子式 ;若实验室用如图所示装置制取X,则制取X的化学反应方程式为 。
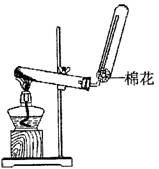
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,
进行如下实验,请补全实验操作、现象和结论:
取上述白色沉淀少量置于试管中,
。
(3)常温下,取10 mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为 ,下列叙述正确的是 (选填字母)。
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化:
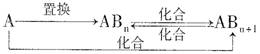
当n=1时,请写出A—ABn的化学方程式 (写出一个即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com