
题目列表(包括答案和解析)
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: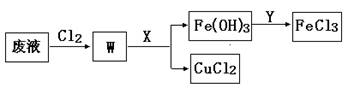
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·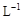 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)

 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)

37.在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式: 。
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式: 。
(3)新制的铜试剂[Cu2(OH)2]与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:![]() (简写为GCHO)
(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式: 。
38.目前,我国铜矿集中分布在长江中下游和云南省,读图8、9回答。

图8

图9
(1)图中A、B、C三个铜矿产地的名称分别是 、 。
(2)铜矿的品位一般在1%左右,故粗铜冶炼在布局上必须 。云南省长期向省外输出粗铜,近年充分利用省内的 资源,在省会兴建了精炼(电解)铜的大型企业,实现了有色金属冶炼的产业升级。
39.铜和氮、磷、钾一样,也是植物必需的矿质元素。根吸收矿质元素的过程与呼吸作用密切相关,因为呼吸作用为矿质元素的离子从土壤溶液进入根细胞内提供 和 。
40.铜钱在历史上曾经是一种广泛流通的货币。
(1)试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃。)
(2)清代采取银、钱并用的货币制度。百姓出卖劳动产品得到的是铜钱,按市场比价折合成白银向国家纳税。清中期以前,银钱比价基本平稳(1两白银=1000文铜钱)。鸦片战争之前以及战后,银钱比价从1000文持续攀升至1300文、1400文、1600文甚至更高,出现空前严重的银荒(银贵钱贱)。试分析其原因及社会影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com