某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
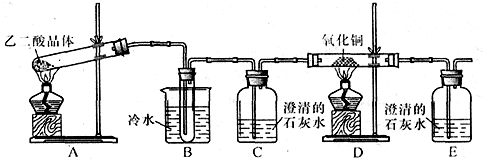
查阅资料可知:乙二酸晶体(H
2C
2O
4?2H
2O)熔点100.1℃,草酸钙是难溶于水的白色固体;Cu
2O能溶于稀硫酸,立即发生歧化反应生成Cu
2+和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:
;
(2)装置B的作用是
除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰
除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰
;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是
在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管)
在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管)
;
将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气)
将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气)
.
(3)实验结束后向装置B的试管中加入NaHCO
3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是
乙二酸大于碳酸(或H2C2O4>H2CO3)
乙二酸大于碳酸(或H2C2O4>H2CO3)
.
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu
2O的混合物.实验小组进一步探究:①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是
红色固体中含有Cu2O
红色固体中含有Cu2O
.②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L.则红色固体中含单质铜的质量分数是
50%
50%
.




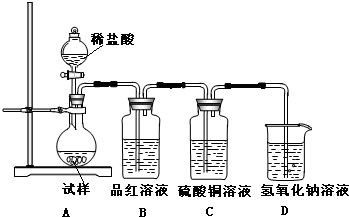 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: