
题目列表(包括答案和解析)
我国规定饮用水质量标准必须符合下列要求(见下表):

下图是原水处理成自来水的工艺流程示意图.
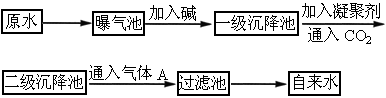
(1)原水中含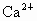 、
、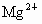 、
、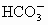 、
、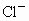 等,加入石灰后生成
等,加入石灰后生成 ,进而发生若干复分解反应,写出其中一个离子方程式_________.
,进而发生若干复分解反应,写出其中一个离子方程式_________.
(2)凝聚剂除去悬浮固体颗粒的过程_________(填写编号,多选倒扣分).
①只是物理过程②只是化学过程③是物理和化学过程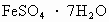 是常用的凝聚剂,它在水中最终生成___________沉淀.
是常用的凝聚剂,它在水中最终生成___________沉淀.
(3)通入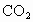 的目的是________和_________.
的目的是________和_________.
(4)气体A的作用是________.这种作用是基于气体A和水反应生成的产物具有_________性.
(5)下列物质中_________可以作为气体A的代用品(填写编号,多选倒扣分).
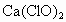
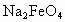
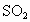
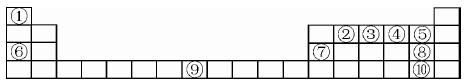
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):

(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为 。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式 ,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式 。
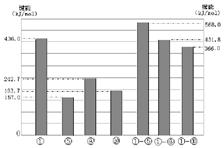
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而 (填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com