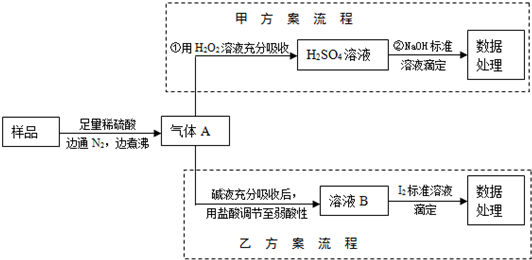
亚硫酸钠和硫代硫酸钠(Na
2S
2O
3)都是重要的含硫化合物.某化学兴趣小组进行以下有关实验,填写下列空白.
实验Ⅰ证明Na
2SO
3中硫元素的价态能发生
→
转化
(1)实验中,不需要用到的试剂有
AD
AD
(填标号).
A.稀硫酸 B.H
2O
2溶液 C.稀盐酸 D.淀粉碘化钾溶液 E.BaCl
2溶液
观察到的现象是
溶液中出现不溶于盐酸的白色沉淀
溶液中出现不溶于盐酸的白色沉淀
.
实验Ⅱ制取硫代硫酸钠晶体
利用如图所示装置进行实验.已知:①硫代硫酸钠能与酸发生反应
②装置d中发生反应:2Na
2S+Na
2CO
3+4SO
2=3Na
2S
2O
3+CO
2
(2)装置b中发生反应的化学方程式为
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
.
(3)装置c的作用是
防止倒吸
防止倒吸
.
(4)装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是
打开K1关闭K2
打开K1关闭K2
,待d中溶液冷却后,倒入蒸发皿,蒸发浓缩,冷却、结晶…获得硫代硫酸钠晶体.
实验Ⅲ测定某硫代硫酸钠样品的纯度(设:样品中只含Na
2SO
3杂质)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品m g,配制成250mL待测溶液.
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na
2SO
3与I
2反应)和少量淀粉溶液,用n mol?L
-1 I
2标准溶液滴定(发生反应:2S
2O
32-+I
2=S
4O
62-+2I
-),至滴定终点.
(5)②中消耗I
2标准溶液VmL,样品中Na
2S
2O
3的百分含量为
(用代数式表示).
(6)该实验方案存在的一个明显缺陷是
缺少平行实验
缺少平行实验
.