
题目列表(包括答案和解析)
水的电离过程为H2O![]() H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.水的电离度α(25℃)>α(35℃)
D.水的电离是吸热的
水的电离过程为H2O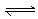 H++OH-,在25℃时水的离子积为KW=1.0×10-14,在35℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是
( )
H++OH-,在25℃时水的离子积为KW=1.0×10-14,在35℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是
( )
A.c(H+)随着温度的升高而降低
B.35℃时c(H+)>c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是个吸热过程
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低 B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小 D.水的电离是个吸热过程
水的电离过程为H2O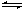 H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
A.[H+]随温度的升高而降低 B.水的电离过程是吸热的
C.水的电离平衡常数与浓度、温度有关 D.在35℃时,[H+] > [OH─]
水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低 B.在35 ℃时,c(H+)>c(OH-)
C.水的电离百分率 α(25 ℃)>α(35 ℃) D.水的电离是吸热的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com