
题目列表(包括答案和解析)
(6分)化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。
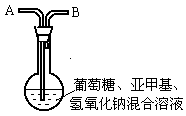 在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
(1)从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
(2)在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
(3)为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2,都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:
。
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒清灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的__________内层的铝并将其裹住,所以不易发生熔滴现象。试写出灼烧铝的化学方程式:________________________________________。
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中其表面产生许多无色气泡,很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。试猜测产生这种现象差异的原因是___________________________________________________________。
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,2—3 min后,铝片表面有气泡,并有少量红色固体附着。试写出铝片表面附着红色固体的离子方程式为_____
_____________________________________________________________________。
(4)再取2条铝片,用砂纸擦去氧化膜,都浸入浓硝酸中,无显著变化,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象同(2)。铝片浸入浓硝酸中无显著变化的原因是________________________________________________________。
(5)另取2条未用砂纸打磨过的铝片,都浸入氢氧化钠溶液中,片刻后其表面产生无色气泡,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象与(2)相似。试写出铝的氧化膜与碱液反应的离子方程式:________________________________。
(6)向步骤(2)、(4)和(5)中的CuSO4稀溶液中滴入3—5滴NaCl稀溶液,铝片表面逐渐产生气泡,且有红色固体析出。
因此据步骤(2)、(4)、(5)和(6)的现象可以得出的结论是________________________。
某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域.铝也有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达2054℃.②铝虽比锌活泼,但是将铝片和锌粒分别投入稀硫酸中,铝比锌反应慢得多.③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜.为此,该小组进行了“铝表面氧化膜”的实验,其过程如下,请完成下列空白.
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软,轻轻摇动会左右摇晃,却不像蜡烛那样滴落.这是因为铝表面氧化膜的________内层的铝并将其裹住,所以不易发生熔滴现象.试写出灼烧铝的化学方程式:________.
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面产生许多无色气泡,很快析出较多红色粉末状固体;另一片浸入CuSO4稀溶液中现象一直不明显.试猜测产生这种现象差异的原因:________.
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,2 min~3 min后,铝片表面有气泡产生,并有少量红色固体附着.试写出铝片表面附着红色固体的离子方程式:________.
(4)再取2条铝片,用砂纸擦去氧化膜,都浸入浓硝酸中,无显著变化,5 min后取出,用水洗净.其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象同(2).铝片浸入浓硝酸中无显著变化的原因是________.
(5)另取2条未用砂纸打磨过的铝片,都浸入氢氧化钠溶液中,片刻后其表面产生无色气泡,5 min后取出,用水洗净.其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象与(2)相似.试写出铝的氧化膜与碱液反应的离子方程式:________.
(6)向步骤(2)、(4)和(5)中的CuSO4稀溶液中滴入3~5滴NaCl稀溶液,铝片表面逐渐产生气泡,且有红色固体析出.因此,据步骤(2)、(4)、(5)和(6)的现象可以得出的结论是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com