
题目列表(包括答案和解析)
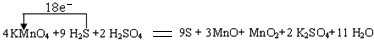
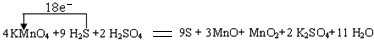
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的物质的量比为3:1。
(1)写出并配平上述化学方程式,标出电子转移方向与数目。
KMnO4 + H2S +H2SO4 →
在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:
KMnO4 + C +H2O →MnO2 + X +K2CO3 (未配平)
(2)X的化学式为__________。
(3) 1mol氧化剂被______(填“氧化”或“还原”)时,生成_____mol氧化产物
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。

(1)反应时,ClO2生成ClO2—、Cl—的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。
(2)亚氯酸根离子(ClO2—)对人体不利。欲在弱碱性条件下将水中的ClO2—转化为Cl—除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
__________________________________________________________________![]() ___________。
___________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4 → 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
① 方法一,当有0.2mol电子![]() 发生转移时,参与反应的还原剂为_________ mol。
发生转移时,参与反应的还原剂为_________ mol。
② 方法二:该反应中H2O2_________(填序号)。
a.发生氧化反应 b.仅做氧化剂 c.既被氧化又被还原 d.既未被氧化也未被还原
③ 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com