
题目列表(包括答案和解析)
(14分) 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至 (填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是 。
⑵操作X包括 、 、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
① 操作c中量取盐酸体积的仪器是 。
② 若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将 (选填“偏大”、“偏小”或“无影响”)。
③ 若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为 。
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子()。饮用水中ClO2、
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使将溶液中的
还原为
以测定其含量,该反应的离子方程式为:
④若饮用水中的含量超标,可向其中加入适量的
将
还原为
,则该反应的氧化产物为 (填化学式)
(14分) 某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一) 制取纯净的氯气
(1) 写出A中反应的化学方程式:____________________________________.
(2) B中加入的物质是:___________________作用是:___________________.
(3) C中加入的物质是:___________________作用是:___________________.
(4) E中反应方程式为:_____________________________________________.
(二) 验证氯气的性质:
(5) B中发生反应的方程式为:_______________________________________.
(6) C中发生反应的方程式为:______________________________________.
(7) D中的反应方程式为:__________________________________________.
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: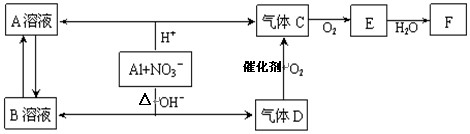
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com