
题目列表(包括答案和解析)
A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
B | 该单质为生活中常见的金属,其相对原子质量比A大8 |
C | 地壳中含量最多的金属元素 |
D | 元素的主族序数是其所在周期序数的3倍 |
E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置__________________;C单质与强碱溶液反应的离子方程式是____________ _。
(2)①在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出a kJ 热量,此反应的热化学方程式是____________________________________________________________。
② A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 ____。
 (3)已知化学反应 A + 2E+ = A2+ + E2 能自发进行,若将上述A、B两种金属,插入含大量E+ 的电解质溶液的烧杯中,可组成原电池。请在右侧方框内相应位置上画出烧杯等,完成原电池电极与用电器连接的示意图。
(3)已知化学反应 A + 2E+ = A2+ + E2 能自发进行,若将上述A、B两种金属,插入含大量E+ 的电解质溶液的烧杯中,可组成原电池。请在右侧方框内相应位置上画出烧杯等,完成原电池电极与用电器连接的示意图。
(4)向2 mL 0.5mol/L的ACl3溶液中加入3 mL 3mol/LKF溶液,ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(已知氧化性Fe3+>I2)
a. A3+不与I-发生反应 b. A3+ 与F-结合生成不与I-反应的物质
c. F- 使I-的氧化性减弱 d. A3+被 F-还原为A2+,使溶液中不再存在A3+
| |||||||||||||||||||||||||||||
⑴.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 ▲ 。(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素。
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验。
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀。
⑵.下列实验能达到实验目的且符合安全要求的是 ▲ 。(可以多选)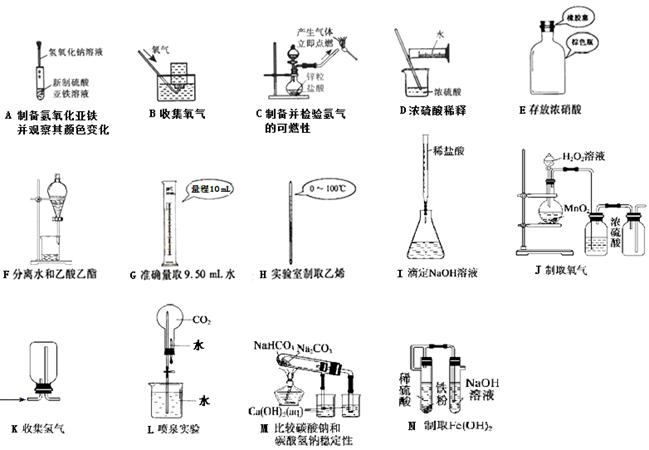
⑶.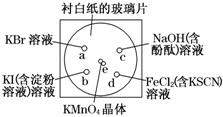 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①.e处发生反应的离子方程式为 ▲ ,该反应中发生反应的氧化剂和还原剂的物质的量
之比为 ▲ 。
②.b处的实验现象为 ▲ ,d处的实验现象为 ▲ 。
③.c处反应的化学方程式为 ▲ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,
转移电子的物质的量为 ▲ mol。
④.通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? ▲ (填“能”或
“不能”),若能,其氧化性由强到弱的顺序是 ▲ 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com