
题目列表(包括答案和解析)



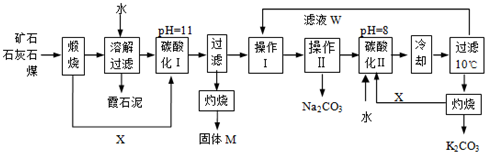
用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

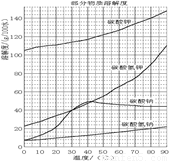
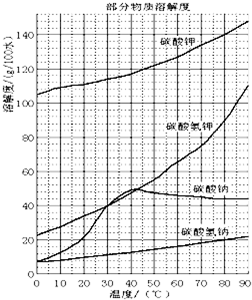
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题:

(1)固体M的化学式是__________, X物质是___________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
(4)操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
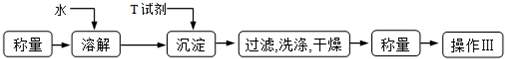
(6)实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。

用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题:
固体M的化学式是__________, X物质是___________。
实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com