
题目列表(包括答案和解析)
| 滴加KSCN溶液 |
| 滴加氯水 |
| 滴加KSCN溶液 |
| 滴加0.1mol/LKI溶液 |
| 滴加6滴0.1mol/LFeCl3溶液 |
| 滴加KSCN溶液 |
| 加2滴K3[Fe(CN)6]溶液 |
| 加入2mLCCl4 |
| 加2滴K3[Fe(CN)6]溶液 |
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液 无明显现象
无明显现象 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液 溶液变红
溶液变红 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式 。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6] 检验的离子是 。
② 黄色溶液中含有的溶质微粒有K+ 、Cl- 和 。
③ 综合上述实验现象,得出的实验结论是 。
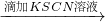 无明显现象
无明显现象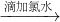 溶液变红
溶液变红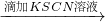 溶液变红
溶液变红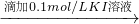 溶液红色未褪去
溶液红色未褪去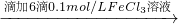 溶液明显变黄
溶液明显变黄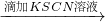 溶液变红
溶液变红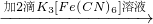 溶液变蓝
溶液变蓝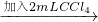 取上层溶液
取上层溶液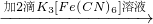 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com