
题目列表(包括答案和解析)
下列是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和Ag NO3溶液反应 | Cu + Ag+ = Cu2+ + Ag | 正确 |
| B | Al 2O3与NaOH溶液反应 | Al3+ + 3O2—+ 2OH—= 2AlO2—+ H2O | 错误,Al 2O3不能写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe + 6 H+ = 2Fe 3+ +3 H2 ↑ | 正确 |
| D | Na和CuSO4溶液反应 | 2Na + Cu2+ = Cu + 2Na+ | 错误,CuSO4不能写成离子形式 |
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7:12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
| ||
| ||
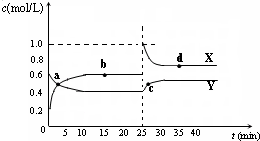 容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
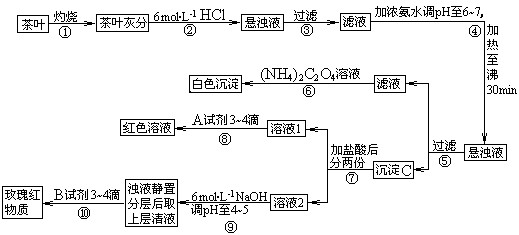
容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2 (填“>”, “<”或“=”)
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2(填“>”,“<”或“=”) 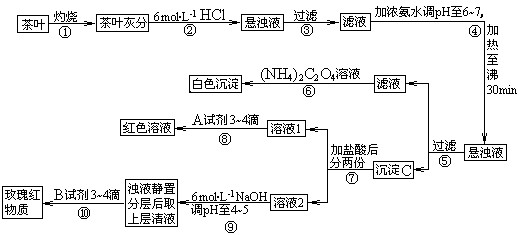
下列反应的离子方程式书写正确的是 ( )
A、铝溶于NaOH溶液:2Al +2OH-+H2O==2 AlO2ˉ+3H2↑
B、氧化铝溶于足量NaOH溶液:Al 2O3+ OH-== AlO2ˉ+ H2O
C、向氢氧化铝沉淀中加入足量盐酸:Al(OH)3+3H+==Al3++3H2O
D、向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O == AlO2ˉ+4NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com