
题目列表(包括答案和解析)
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(3)Y 与Z 可形成YZ42-
① YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
 (4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
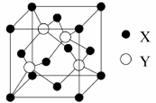
(5)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
③已知该化合物晶体的晶胞边长为a cm,阿伏伽德罗常数为NA mol-1,则该晶体密度为____________________________g·cm-3(列出表达式即可)。
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |





| A | |||||||||||||||||
| B | C | D | |||||||||||||||
| E | X | Y | |||||||||||||||
| Z | W |

X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关回答均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_______。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________。
(3)X与Z中电负性较大的是__________;Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是_____,此离子中含有的化学键类型是____;X一Z一X的键角_____109. 50。(填“>”、“=”或“<”)
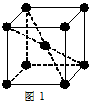
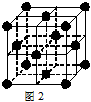
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以相距一个X离子最近的所有Y离子为顶点构成的几何体为 。该化合物与MgO相比,熔点较高的是_____。

(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为____g/cm3。(列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com