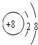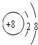(2013?湖南模拟)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
周期 |
IA |
|
0 |
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥简单离子半径由大到小的顺序为
O2->Na+>Al3+
O2->Na+>Al3+
.
(2)⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是
HClO4>H2SO4>H2SiO3
HClO4>H2SO4>H2SiO3
.
(3)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)
ab
ab
.
a.MnO
2b.FeCl
3c.Na
2SO
3d.KMnO
4(4)图中 A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:
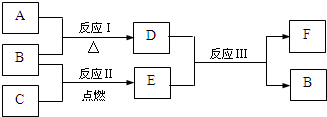
Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色.
①F的电子式为
.
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是
2:1
2:1
.
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍.
①下列关于D的说法正确的是
bc
bc
(填字母).
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.