
题目列表(包括答案和解析)
下图是元素周期表的一部分
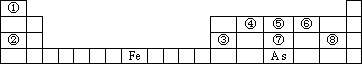
Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为________.
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是________.
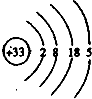
(3)As的原子结构示意图为________,其氢化物的化学式为________.
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为________,当消耗1 mol还原剂时,电子转移了________mol.
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为________.
(6)工业上常用热还原法冶炼X,写出其化学方程式________.
(7)某温度下(﹥100℃)若m克X与H2O反应放出QKJ(Q>0)的热量,写出该反应的热化学方程式________.
(8)少量X与B的稀溶液反应生成C的离子反应方程式为________.


| ||
| ||
| 168Q |
| m |
| 168Q |
| m |
(14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
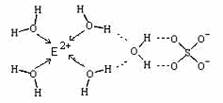
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
(14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)

(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com