
题目列表(包括答案和解析)
 出发来合成A,合成路线如下:
出发来合成A,合成路线如下: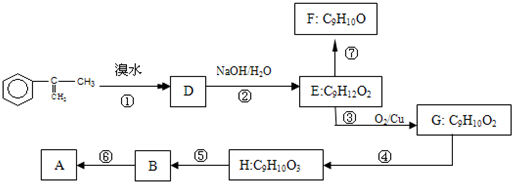

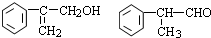
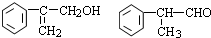




| H2 | Pd/C |


 (任写一个)
(任写一个) (任写一个)
(任写一个)

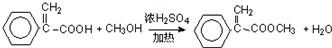
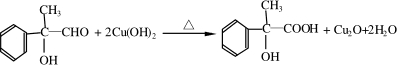
 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).

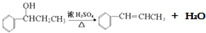
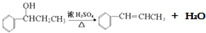
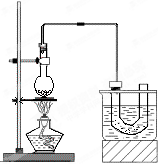 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)| △ |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)
请填写下列空白:
(1)B的电子式为 ;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:
;
(3)反应⑥的化学方程式为 ;
反应④在冶金工业上属于 (填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为 ;
(5)反应②的化学方程式为 ;
反应③的离子方程式为 ;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为 。
(6分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1∶1 B.1∶3 C.1∶4 D.2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com