
题目列表(包括答案和解析)
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| (1) | 制氧气 | H2O2→O2 | C C |
| (2) | 制氨气 | NH4Cl→NH3 | B B |
| (3) | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||

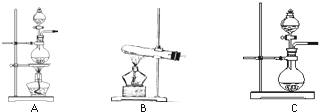 下表是实验室制备气体的有关内容:
下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C C |
| ② | 制氨气 | NH4Cl→NH3 | B B |
| ③ | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | ______ |
| ② | 制氨气 | NH4Cl→NH3 | ______ |
| ③ | 制氯气 | HCl→Cl2 | ______ |
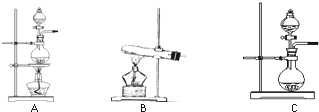
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
| ||
| ||


 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
2.1 2.1 |
250 250 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com