
题目列表(包括答案和解析)
 (1)在一烧杯中盛有稀H2SO4 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,(如图).向该烧杯里缓缓注入与稀H2SO4 等密度的Ba(OH)2 溶液至恰好完全反应.则在此实验过程中:①烧杯里观察到的现象为
(1)在一烧杯中盛有稀H2SO4 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,(如图).向该烧杯里缓缓注入与稀H2SO4 等密度的Ba(OH)2 溶液至恰好完全反应.则在此实验过程中:①烧杯里观察到的现象为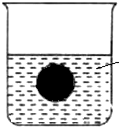 如图所示,在一烧杯中盛有100mlH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央.向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应,在此过程中:
如图所示,在一烧杯中盛有100mlH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央.向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应,在此过程中:某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com