
题目列表(包括答案和解析)
实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法中不正确的是( )
A.由题目信息知:KMnO4的氧化性比MnO2的强
B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂
C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体
D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol
| A.由题目信息知:KMnO4的氧化性比MnO2的强 |
| B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 |
| C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 |
| D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法中不正确的是( )
| A.由题目信息知:KMnO4的氧化性比MnO2的强 |
| B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 |
| C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 |
| D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如右图所示)。
 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:准确量取残余清液稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.1000 mol·L—1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为 mol·L—1;
b.平行滴定后获得实验结果。
 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×![]() 、Ksp(MnCO3)=2.3×
、Ksp(MnCO3)=2.3×![]() ]
]
④进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因
是 (排除仪器和实验操作的影响因素)。
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。
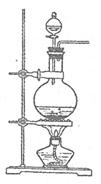 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加人MnO2粉末 B.加热 C.往烧瓶中加人浓盐酸
 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到
中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com