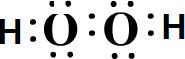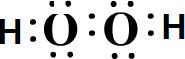现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上的电子数是原子核外电子层数的2倍 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z |
原子最外层电子数是次外层的三倍 |
| M |
与X、Y、Z既能形成10电子分子又能形成18电子分子 |
完成下列问题:
(1)元素T在周期表中位于第
3
3
周期第
16
16
纵行.
(2)T、X、Y、Z、M原子半径由大到小的顺序是
S>C>N>O>H
S>C>N>O>H
.
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是
.
(4)元素Z与元素T相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这
bd
bd
.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为
10-5mol/L
10-5mol/L
.
(6)右图为元素X与Z形成的化合物分子XZ
2的晶胞结构,在该晶胞中,离每一个XZ
2最近的XZ
2有
12
12
个,若

已知该晶胞的边长为a cm,XZ
2的摩尔质量为M g/mol,阿伏伽德罗常数为N
A.则该晶胞的密度为
4M/(a3NA)
4M/(a3NA)
g/cm
3.(写出表达式)