
题目列表(包括答案和解析)
A、B、C、D、E五种物质是由常见元素组成,A由两种元素组成,且A中两种元素的质量比为7∶8。A和B在高温条件下反应生成C和D,C为无色气体,在标准状况下的密度约为2.86g∙L-1。以A为原料生产E。

⑴写出A的化学式:
⑵A和B的反应中,还原剂与氧化剂的物质的量之比为 ,
⑶某人设想用右图所示装置利用电化学原理生产E,则N电极是 极;写出M电极的电极反应式: 。
⑷当图中的C与O2被活性炭吸附时,也能发生反应生成F,为研究此反应,将C和O2放入体积为2L的恒容密闭容器中,在500℃时发生反应,反应过程中的能量变化如下图所示,反应物物质的量和时间的变化如下表所示:

①该反应的ΔH 0反应从起始至2min内的平均反应速率v(C)= ;
500℃时,此反应化学平衡常数K的值为 。
②第6min时,向容器中再充入0.002molO2,同时将反应体系的温度改变为T,反应至10min时重新达到平衡,此时测得c(C)=0.006mol∙L-1,则温度T (填“>”或“<”)500℃。
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂;X、Y、Z最夕层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g 。请回答下列问题:
。请回答下列问题:
(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)________________。
(2)Q在周期表中的位置是____________。
(3)X、Y、Q三种元素’形成的三原子分子结构式为______________;M、Q元素形成的最高价氧化物对应的水化物中较强的酸是(写化学式)_____________。
(4)Y与Z形成的化合物A既含离子键又含共价键,A的电子式为______________________;
将A加入盛有酚酞试液的试管中观察到的现象为_________________________________,发生反应的化学方程式为_________________。
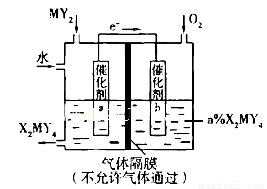
(5)利用下列装置可将化合物MY2转化为重要化工原料H2MY4。电极a的催化剂表面发生的电极反应方程式为__________________________________;理论上通人MY2与O2的物质的量最佳比值为________________。
下列叙述中正确的是( )
| A.向Na2CO3饱和溶液中加入1.06g Na2CO3粉末,恢复至室温,析出2.86g Na2CO3·10H2O晶体 |
| B.向2mL CuSO4溶液中滴加2滴同浓度的NaOH溶液,向所得浊液中加入0.5 mL乙醛,加热至沸腾,有红色沉淀生成 |
| C.将1 L 2mol·L-1的FeCl3溶液加入到沸水中,加热使之形成红褐色液体,该液体中Fe(OH)3的胶粒数小于2NA |
| D.氢氧化铁胶体稳定存在的主要原因是胶粒做布朗运动,向其中滴加少量稀硫酸,将有沉淀产生 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com