
题目列表(包括答案和解析)
(1)下列实验操作或对实验事实的叙述中存在错误的是____________(填序号)。
A.用50 mL酸式滴定管准确量取25.00 mL KMnO4酸性溶液,放入锥形瓶中待用
B.在测定硫酸铜晶体的结晶水含量时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C.中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D.实验室中进行的下列实验均需水浴加热:
①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备 ④淀粉、纤维素的水解
E.配制1 mol·L-1的NaOH溶液时,下列操作均会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
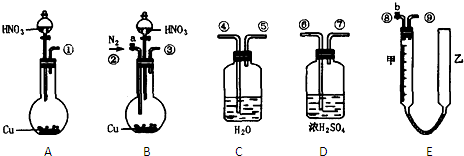
(2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100 cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其他夹持装置已略去。(不考虑可逆反应)
操作步骤:

①检查装置的气密性
②将0.5 g红磷平铺在电热板上,盖紧容器
③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0 cm
④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷……
请回答下列问题:
(i)检查装置气密性具体方法是____________________。
(ii)实验步骤③加入的液体C是____________(填名称)。
(iii)反应结束并充分冷却后,读取B中液面刻度读数时,应注意________________________;若液面在刻度5.6 cm处,此时实验条件近似看作标准状况,则生成物PClx中x的值是____________(计算结果保留1位小数)。
下图装置测定中和热的实验步骤如下: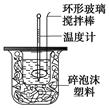
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol) 。
(2)倒入NaOH溶液的正确操作是 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
下图装置测定中和热的实验步骤如下:
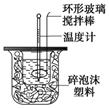
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol) 。
(2)倒入NaOH溶液的正确操作是 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
|
温度
实验次数 |
起始温度 t1/℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
|
2 |
25.9 |
25.9 |
25.9 |
29.2 |
|
|
3 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
| V-11.2n |
| 33.6n |
| V-11.2n |
| 33.6n |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com