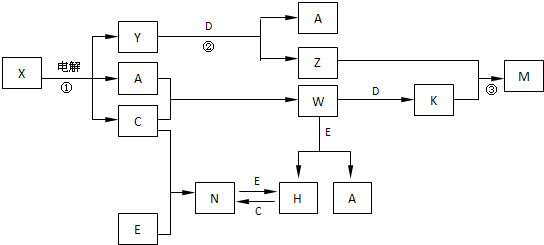
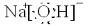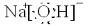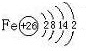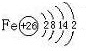A、B、C、D、E是中学化学常见单质,构成它们的元素的原子序数分别为a、b、c、d、е;且3(a+b)=2(a+c)=3(d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H
2O已略去):

(1)Y的电子式为
,构成E单质的元素的原子结构示意图为:
.
(2)反应③的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
(3)E的氧化物与D在一定条件下反应的化学方程式为:
,在实验室中,引发该反应的实验操作为
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
.
(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
.
(5)用离子方程式表示Z溶液显碱性的原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.
(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H
2O中,据此判断N为
分子
分子
晶体.
(7)25℃时,PH=5的W和N的水溶液中由H
2O电离出来的H
+离子浓度之比为
1:104
1:104
.

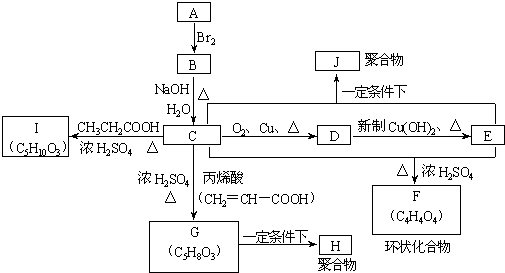
 RCH=CH2
RCH=CH2 
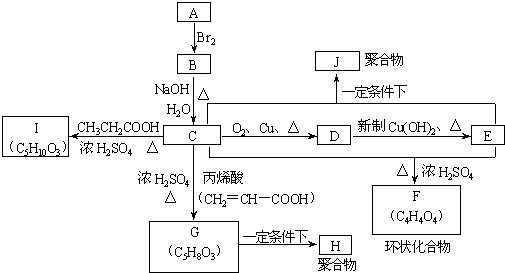


 +(2n-1)H2O
+(2n-1)H2O +(2n-1)H2O
+(2n-1)H2O